两月前,国家药监局官网公示,安斯泰来(Astellas Pharma Europe B.V.)申报的进口药佐妥昔单抗(Zolbetuximab)在国内获批上市,佐妥昔单抗是目前全球首个且唯一获批的CLDN18.2(Claudin18.2)靶向治疗药物。

该药联合含氟尿嘧啶类和铂类药物化疗用于CLDN18.2阳性、人表皮生长因子受体2(HER2)阴性的局部晚期不可切除或转移性胃或胃食管交界处(GEJ)腺癌患者的一线治疗。目前已在中国、美国、欧洲、日本、韩国等多个国家和地区获批上市。
CLDN18.2是一种细胞间紧密连接蛋白亚型,通常埋藏在正常胃上皮细胞的紧密连接中,难以被抗体识别;但在胃癌恶性转化过程中,细胞极性和结构的破坏导致CLDN18.2暴露于胃和胃食管交界处(G/GEJ)腺癌细胞的表面,使其更易被抗体接触。
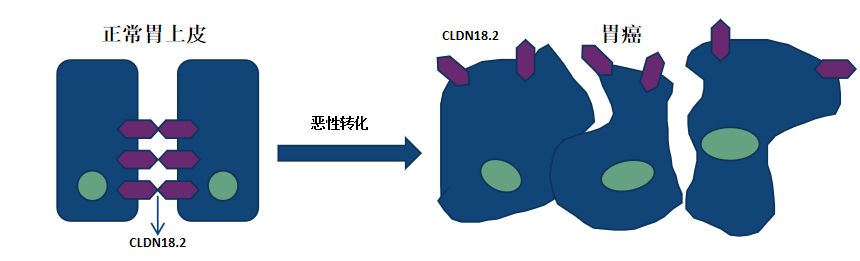
据诸多报道,CLDN18.2 被视为胃癌领域继HER2后的新兴高潜力靶点。研究数据显示,约38%的胃癌患者表达 CLDN18.2[1][2],这一比例显著高于 HER2 阳性患者的 8.8%~12%[3][4] ;并且,CLDN18.2在胃癌、食管癌、胰腺癌、肺癌等多种肿瘤中皆呈现高表达。
针对CLDN18.2靶点的药物研发具有巨大市场潜力和竞争价值。据不完全统计,全球有超 70 款 CLDN18.2 相关抗体新药处于研发活跃状态,由中国企业研发的高达 58 款,占比 75% 以上。目前已有 7 款国产新药进展到 III 期临床阶段。
靶向CLDN18.2单克隆抗体佐妥昔单抗于2024年3月获得日本厚生劳动省(MHLW)批准,成为全球首个被监管机构批准的CLDN18.2靶向治疗药物。而后陆续在欧盟、韩国、美国、中国等地获批。
佐妥昔单抗通过与肿瘤细胞表面 CLDN18.2 特异性结合,激活抗体依赖的细胞毒性作用(ADCC)和补体依赖的细胞毒性作用(CDC),从而诱导肿瘤细胞凋亡。
该药物的两项 III 期临床试验均达到积极结果:
SPOTLIGHT(NCT03504397) 研究结果显示,接受联合化疗的中国受试者的 PFS (无进展生存期)为 9.8个月,相较于安慰剂组的 6.5 个月显著提升。OS (总生存期)方面,接受联合化疗的中国受试者达 16.7 个月,高于安慰剂组的 13.2 个月。
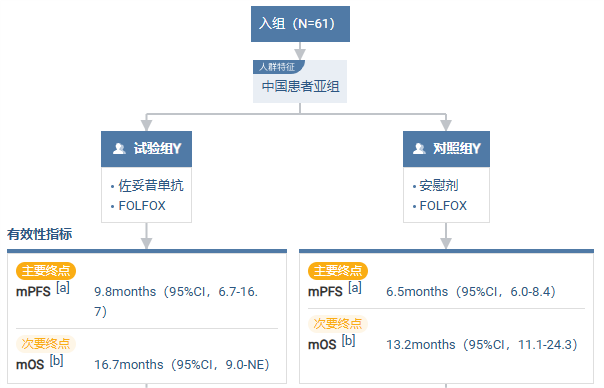
结论:在SPOTLIGHT研究的最终0S分析中,接受佐妥昔单抗联合mFOLFOX6治疗的CLDN18.2阳性、HER2阴性的局部晚期不可切除或转移性胃或GEJ腺癌中国患者在PFS和0S方面显示达到治疗获益,具有临床意义。中国患者人群中的安全性和有效性结果与全球人群大体相似,未观察到新的安全性信号。
GLOW (NCT03653507)研究结果显示,接受联合化疗的中国受试者的 PFS(无进展生存期) 为8.3 个月,相较于安慰剂组的 6.1 个月显著提升。OS(总生存期) 方面,接受联合化疗的中国受试者达 14.5个月,高于安慰剂组的 10.7个月。
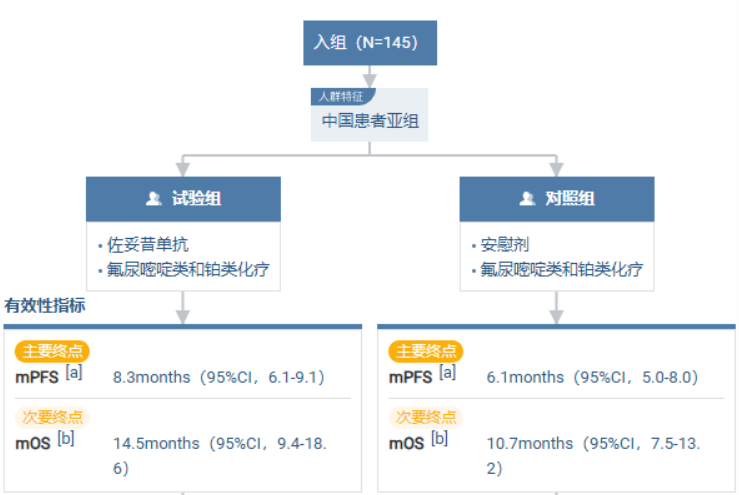
结论:在GLOW研究的最终0S分析中,接受佐妥昔单抗联合CAPOX治疗的CLDN18.2阳性、HER2阴性的局部晚期不可切除或转移性胃或GEJ腺癌中国患者在PFS和0S方面显示达到治疗获益,具有临床意义。中国患者人群中的安全性和有效性结果与全球人群大体相似,未观察到新的安全性信号。
免疫组化凭借其普及性、便捷性以及经济性等优势,成为检测CLDN18.2表达较为成熟的方法。《2024CSCO胃癌诊疗指南》及《2024 ASCO GI》两大指南皆推荐“抗Claudin18.2免疫组化检测”——针对标准治疗失败的晚期或复发胃癌患者,为了寻找潜在的治疗靶点,可进行Claudin18.2、FGFR2、C-MET、NTRK基因等标记物检测。“CSCO胃癌诊疗指南”相关推荐等级,由2023版的Ⅲ级推荐改为2024版Ⅱ级推荐。

》》判读规则:
根据最新版NCCN胃癌指南(2024.V5版),Claudin18.2阳性由肿瘤细胞完整、基底外侧或外侧膜染色的强度,以及肿瘤细胞膜着色所占百分比两个方面决定。
①判断Claudin18.2蛋白在肿瘤细胞膜染色的强度,以及完整、基底外侧或外侧膜染色的癌细胞百分比。染色强度可分为0(细胞膜或细胞质无反应)、1+(细胞膜或细胞质弱反应性)、2+(细胞膜或细胞质中反应)、3+(细胞膜或细胞质强反应性)。
② Claudin18.2阳性:在≥75%的肿瘤细胞中,任何染色强度为2+或3+(总数)的肿瘤。
● 阳性标准:≥75%的肿瘤细胞显示中等至强膜染色
● 阴性标准:<75%的肿瘤细胞显示中等至强膜染色
● 阳性对照:使用正常胃粘膜上皮细胞作为3+ 内对照
》》注意事项:
1.建议多取活检标本,6-8块为最佳,以避免假阴性结果。无论采集方法(活检或切除)和部位(原发或转移)如何,CLDN18.2阳性率相似,表明可以使用来自原发或转移部位的样本,通过免疫组化筛查CLDN18.2的表达状态;
2.标本离体后应尽快固定,建议在30分钟内处理,以确保固定效果。固定液要充分浸泡标本,大标本固定时间需12小时以上,小标本也需充分固定;
3.切片厚度约4μm,过厚可能导致细胞层叠,影响判读;过薄可能影响标记部位的准确性。合适的切片厚度有助于提高染色质量和判读的准确性;
4.建议使用正常胃黏膜上皮作为内对照,以验证染色成功;
5.建议采用逐步法来评估CLDN18.2染色结果。第一步首先在HE切片上找到侵袭性癌区域,确保该区域至少包含50个癌细胞,才可进行后续评估,同时需要排除坏死、组织碎片、挤压伪影等非肿瘤区域,这些因素可能影响判读的准确性。第二步免疫组化切片观察,包括特异性和强度的评估,主要关注中度至强阳性(2+或3+)的膜染色。使用正常胃粘膜上皮细胞作为3+内对照,证实染色成功,并帮助识别阳性细胞,这有助于验证染色结果的可靠性和准确性。第三步计算阳性细胞百分比,计算2+和3+的肿瘤细胞占总肿瘤细胞的百分比。
迪安生物基于自主研发的CLDN18.2(Claudin18.2)抗体,能够特异性识别癌症组织中的CLDN18.2抗原,染色稳定性强,背景干净清晰,对精准识别和治疗CLDN18.2表达阳性的胃或食管胃结合部腺癌等患者具有重要临床意义。
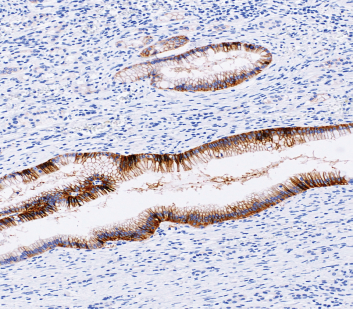
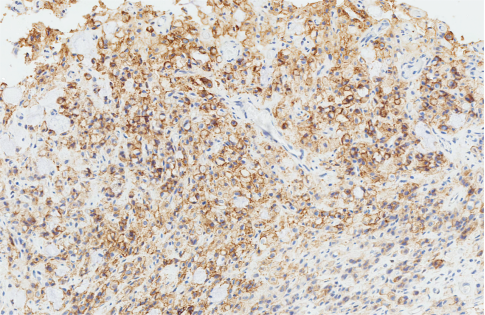
正常黏膜内对照 胃腺癌
参考文献
[1]种晓艺, 等. 中国肿瘤临床. 2021, 48(8): 420-425.
[2]Shah MA, Shitara K, Ajani JA, et al. Nat Med. 2023 Aug;29(8)_2133-2141.
[3]黄丹, 李增山, 樊祥山, 等. 中国人40842例胃腺癌HER2多中心检测结果分析[J] . 中华病理学杂志, 2018, 47(11) : 822-826.
[4]《胃癌HER2检测指南(2016版)》专家组. 胃癌HER2检测指南(2016版). 中华病理学杂志,2016,45(08):528-532.
*以上内容仅作资讯整合解读分享,不作为任何实际医患诊疗建议参考;内容如涉及版权问题请及时联系删除。


