EBV,广泛传播的人类疱疹病毒
EBV是1964 年在伯基特淋巴瘤(Burkitt lymphoma,BL)中发现并分离的一种双链 DNA 病毒,在世界各地绝大多数人都是终身的无症状感染者。根据国际癌症研究署(IARC)致癌因子的分类标准,EBV位列第一组致癌因子。人类是EBV天然宿主之一,其是传染性单核细胞增多症的病原体,也是一种重要的肿瘤相关病毒。
EBV 感染影响人体的免疫反应,主要感染 B 淋巴细胞和上皮细胞,并在淋巴细胞的致癌转化中起致病作用,与多种淋巴瘤的发生、发展有密切联系,如霍奇金淋巴瘤(Hodgkin lymphoma,HL)、弥漫性大 B 细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)、原发性中枢神经系统淋巴瘤、移植后淋巴细胞增生性疾病(post-transplant lymphoproliferative disorder,PTLD)、胃癌、伯基特淋巴瘤、结外 NK/T细胞淋巴瘤等。因此,EB 病毒的存在对许多人类癌症的确切影响是一个值得深究的热点问题。
EBV 通常在其生命周期中建立两个阶段,潜伏期和裂解复制期。它主要通过唾液、体液、器官移植和输血等方式在人群之间进行传播,大约95%的成年人有过感染或处于潜伏感染状态。
EBV的感染路径
1. 急性EBV感染
EBV 主要通过唾液传播,进入人体后先感染口咽黏膜上皮细胞,当上皮细胞被感染后,EBV会在细胞内组装产生病毒颗粒,释放到血液中,感染静息状态下的初始B细胞(navie B cell)。被感染的B淋巴细胞会继续产生大量的EB病毒颗粒,继续进入血液循环,从而导致全身性的感染。
2. 慢性EVB感染
EBV 感染人体后诱发的机制可分为两个方面。一方面是病毒引起机体免疫紊乱,活化的 T 淋巴细胞刺激巨噬细胞分泌超量的细胞因子,导致全身炎症反应及淋巴细胞持续的异常活化。另一方面病毒通过潜伏期蛋白激活多条肿瘤信号通路,抑制宿主细胞凋亡,诱导淋巴细胞异常增殖转化,从而导致肿瘤的发生。
EBV相关疾病
EBV潜伏感染被认为是病毒致肿瘤作用的主要机制,根据被感染细胞表面表达的抗原不同,潜伏感染分为4型:
●Ⅰ型 潜伏感染主要见于 Butkitt’s淋巴瘤(BL);
● Ⅱ型 潜伏感染主要见于鼻咽癌、胃癌、霍奇金淋巴瘤(HL)及NK/T细胞淋巴瘤;
● Ⅲ型 潜伏感染主要见于弥漫性大B细胞淋巴瘤(DLBCL)及免疫抑制患者的淋巴组织增生性疾病;
● Ⅳ型 潜伏感染仅发生在健康病毒携带者的B淋巴细胞中。
1. 鼻咽癌
鼻咽癌是发生在鼻咽腔顶部和侧壁的恶性肿瘤,是目前最为明确的与EBV感染相关的人类上皮性肿瘤,其发病率居耳鼻咽喉恶性肿瘤首位,位列中国肿瘤发病率前10位。在中国,鼻咽癌主要发生在广东、广西、福建等中南部沿海地区,且男性阳性率高于女性,中年人为主,少数为年轻人。
鼻咽癌恶性率高,早期可发生颈部淋巴结转移。许多患者在出现明显症状后,已经处于晚期阶段,因此鼻咽癌的早诊早治非常重要。
2. 淋巴瘤
EBV相关淋巴瘤为淋巴细胞发生恶变而致的恶性肿瘤,可发生于 B 淋巴细胞、T 淋巴细胞或NK 细胞,主要包括霍奇金淋巴瘤(Hodgkin lymphoma,HL)和非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)。
数据显示,大概近二十年来,总体上我国霍奇金淋巴瘤的发病例数呈增长趋势,大部分初治患者可在接受规范化治疗后治愈,但也存在少部分复发、难治现象。因此,采用更加有效的检测方法对患者而言意义重大。
3. 胃癌
胃癌是人体中最常见、最多发、危害最大的恶性肿瘤之一。研究发现,EB病毒感染是胃癌的主要病因之一,EB病毒相关胃癌(Epstein-Barr virus-associated gastric cancer,EBVaGC)约占所有胃癌的1.3%~30.9%。
2014年,美国癌症基因组图谱研究计划(the Cancer Genome Atlas,TCGA)提出了新的胃癌分子分型,将胃癌肿瘤类型分为 EB病毒(Epstein-Barr virus,EBV)阳性、微卫星不稳定型、基因组稳定型和染色体不稳定型。
4. 炎症性肠病(IBD)
少数情况下IBD患者的肠活检组织中可以检测到较多EBER阳性的淋巴细胞,特别是在溃疡性结肠炎的患者中。此类EBV感染是一种机会性感染,在IBD病程中的作用还不清楚。
什么是“EBER检测”?
目前临床常用的 EB 病毒检测方法包括:
● 外周血EB 病毒 - DNA 定量检测;
● 外周血 EB 病毒抗体检测;
● 免疫组织化学( immunohistochemistry,IHC) 检测;
● EB 病毒编码的小RNA( EB virus encoded small RNA,EBER) 原位杂交( in situ hybridization,ISH) 等方法。
EBER 原位杂交因其敏感性高、特异性强、定位精准等原因成为活检组织中诊断EB病毒感染的金标准,可为肿瘤筛查、诊断、治疗、及预后判断提供可靠的病理学依据。
免疫组化法:
EBV潜伏膜蛋白1(LMP-1)被公认为病毒基因组编码的“具有促细胞癌变和转移作用”的瘤蛋白, LMP-1可通过免疫组化法进行检测,使胞质和胞膜着色,客观表现出被感染细胞中EB的蛋白表达情况。然而,免疫组织化学法仅能检测病毒蛋白质表达阶段,对于细胞内EB低拷贝的检测灵敏性稍差。
原位杂交法:
EBER原位杂交检测技术是公认的EB病毒标准检测方法。对比免疫组化,原位杂交为核酸水平,免疫组化为蛋白水平,抗原抗体反应,杂交更具有特异性。对比非原位方法,EBER原位杂交技术在检测EBV时具有定位作用,能够确定病毒与组织和细胞的关系。
在EBER原位杂交检测中,使用的是寡核酸探针对已知的EBER1和EBER2两个RNA分子进行杂交,用地高辛抗体标记的核苷酸片段按EBER1和EBER2的特定碱基序列进行互补性设计,最后再经过辣根过氧化物酶-酶底物化学显色反应来完成,此过程不仅能实现EBV的检测,亦可提高诊断灵敏度,实现定位准确且特异性强,是公认的EB病毒标准检测方法。
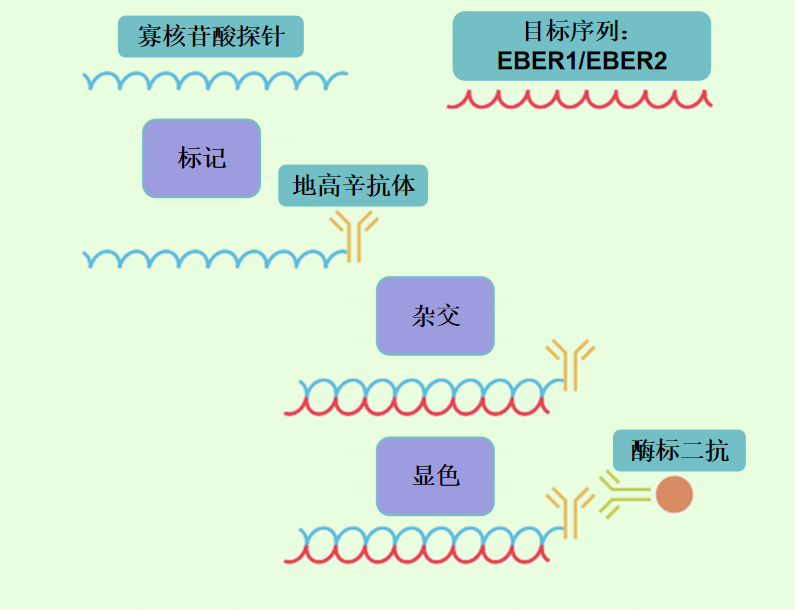
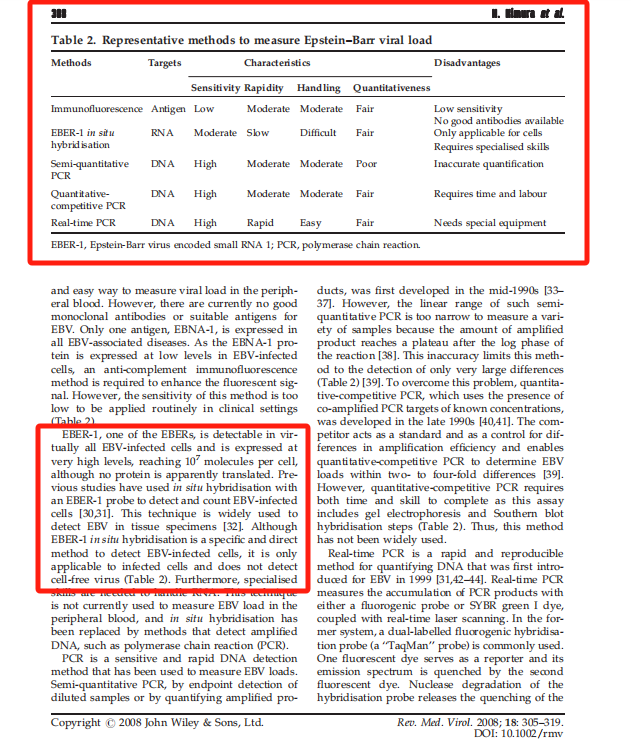
EBER ISH是判断器官组织标本EBV感染的金标准(by:Reviews in medical virology, 2008, 18(5): 305-319.)
金迪安® EBER原位杂交检测
由迪安生物推出的EBER探针(原位杂交法),搭配金迪安®全自动免疫组化染色仪DH-4800 Plus,可全自动完成高质量实验,提高科室工作效率,增加科室检测项目,欢迎垂询试用。

DH-4800 Plus可一键完成烤片、脱片、脱蜡、抗原修复直至复染全过程。除常规的免疫组化实验,还支持原位杂交、细胞免疫化学染色,细胞双染以及组织双染等实验。标准的流程、精密的加样、稳定的环境,帮助实验室获得高质量的染色结果。

参考文献:
[1]Liu J, Chen Z, Li Y, et al. PD-1/PD-L1 Checkpoint Inhibitors in Tumor Immunotherapy[J]. Front Pharmacol, 2021, 12:731798.
[2]Caetano BFR,Jorge BAS, Muller-Coan BG, et al. EpsteinBarr virus microRNAs in the pathogenesis of human cancers[J]. Cancer Lett,2021,499:14-23.
[3] Yoon CJ,Chang MS,Kim DH,et al. Epstein-Barr virus-encoded miR-BART5-5p upregulates PD-Ll through PIAS3pSTAT3 modulation, worsening clinical outcomes of PD-Llpositive gastric carcinomas[J]. Gastric Cancer,2020 , 23(5) :780-795.
[4] Yang J, Liu ZF , Zeng B, et al. Epstein-Barr virus-associatedgastric cancer:a distinct subtypel]]. Cancer Lett,2020,495:191-199.
[5] Gonzalez H, Hagerling C, Werb Z. Roles of the immune system in cancer: from tumor initiation to metastatic progression[J]. Genes Dev, 2018, 32(19-20):1267-1284.
[6] Yu F,Lu Y,Petersson F,et al. Presence of lytic Epstein - Barr virus infection in nasopharyngeal carcinoma[J]. Head Neck,2018,40( 7) :1515 - 1523.
[7]Goodman A, Patel SP, Kurzrock R. PD-1-PD-L1 immune-checkpoint blockade in B-cell lymphomas[J]. Nat Rev Clin Oncol, 2017, 14(4):203-220.
[8] Shah KM, Young LS. Epstein-Barr virus and carcinogenesis: beyond Burkitt's lymphoma[J]. Clin Microbiol Infect, 2009, 15(11):982-988.
[9] Epstein MA, Achong BG, Barr YM. VIRUS PARTICLES IN CULTURED LYMPHOBLASTS FROM BURKITT'S LYMPHOMA[J]. Lancet, 1964, 1(7335):702-703.
[10]刘江华,刘炜,李彦格. 原发与再激活 EB 病毒感染相关噬血细胞性淋巴组织细胞增生症的比较分析[J]. 中国实验血液学杂志,2023,31( 2) : 575 - 580.
[11]滕孝静,程鸣,周贺等.免疫组织化学切片行EBER原位杂交检测方法的建立及应用[J].临床和实验医学杂志,2023,22(15):1660-1664.
[12]成敏蓉, 刘杭丰, 高书华, 等. 唾液酸免疫球蛋白型凝集素-15 促进结直肠癌细胞增殖和迁移并 抑 制 肿 瘤 组 织 中 CD4~+ 与 CD8~+T 细 胞 浸 润 [J]. 中 国 生 物 化 学 与 分 子 生 物 学报,2022,38(05):621-629
[13] 马会敏, 李鑫, 吕柯冰, 等. 自体造血干细胞移植与 PD-1 抑制剂对复发难治性霍奇金淋巴瘤的疗效对比[J]. 中华肿瘤防治杂志, 2022, 29(05):369-375.
[14]武文韬, 李达宁, 郑帅, 等. 1990—2019 年中国霍奇金淋巴瘤流行趋势和疾病负担分析[J]. 医学新知, 2021, 31(06):433-440.
[15]陈永钦,陈鹭姗,杨映红.全自动免疫组织化学仪在EBER原位杂交和免疫组织化学双重染色中的应用[J].中华病理学杂志,2020,49(6):623-624.
[16]吴文娟,王新明,许东勤等.鼻咽癌患者中EB病毒抗体研究概述[J].中国医学工程,2023,31(09):42-46.


